GMP에서는 조직의 완비, 책임체제의 확립, 기준의 제정·준수, 기록 등이 중요한 것으로 규정되어있으나
이것만으로 제조관리가 충분하다고는 할 수 없으며 이것은 GMP의 한 측면에 불과하다.
FDA의「공정 validation지침」에는 다음과 같이 규정되어있다.
『품질보증의 기본원칙은 사용목적에 적합한 제품을 제조하는 데 있으며 그 원칙은 다음과 같이 말할 수 있다.
① 품질, 안전성 및 유효성은 제품 중에 설계되어 만들어지지 않으면 아니 된다.
② 품질은 최종제품의 검사·시험만으로는 보증할 수 없다.
③ 제조공정의 각 단계는 최종제품이 모든 품질규격 및 설계규격에 합치되도록 최대한의 관리를 해야한다.
공정 validation은 이러한 품질보증의 목표에 도달하기 위한 열쇠와 같은 것이다.
제조공정과 그 관리에 있어서 신중하게 설계하고 validation함으로써 제약회사는 생산되는 모든 제조단위가 제품규격에 틀림없이
적합하게 된다는 강한 확신을 가질 수 있다.
공정을 validation하면 반제품 및 완제품의 시험에 과도하게 의존할 필요도 없어진다.
1) 제조 변동요인의 배제
의약품의 제조공정에는 많은 요인이 관여하고 있고 과학기술의 진보와 더불어 방법이나 설비·기기도 점점 더 정교하고 복잡해지고 있다. 따라서, 변동요인이 많아지며 그 방법, 공정 또는 조작법의 신뢰성을 확보하기 위해서는 각각의 요인에 대해서 또는 공정 전체로서 초기의 목적대로 기능하고 있다는 것을 과학적으로 검증하고 확인해 나가지 않으면 아니 된다.
즉, 모든 표준을 설정하려면 검토의 단계, 시험제조의 단계, 생산 준비의 단계에서, 그리고 설비·기기에 있어서는 설계, 설치 및 가동의 단계를 통해서 원재료, 기계설비, 작업표준, 시험방법 등에 포함되어 있는 변동요인을 파악해서 그 영향을 받지 않도록 변동요인을 배제하거나 관리 포인트를 명확히 하지 않으면 아니 된다. 이를 위한 체계적 확인시스템이 바로 validation이다.
2) GMP의 기반구축
GMP에서는 관리조직의 정비, 제(諸)기준의 설정, 설정기기의 완비 등을 규정하고 있는데, 그 전제로서 다음과 같은 사항들이 명확히 되어있어야 한다.
① 어떠한 설비·기기를 설치하는 것이 적절한가?
② 어떠한 제조방법 또는 시험·검사방법을 설정하는가?
③ 관리 포인트는 무엇인가?
④ 설비·기기, 제조방법, 시험방법이 최적이라는 것을 어떻게 확인하는가?
⑤ 목표로 하는 품질기준은 적정한가?
이러한 사항들이 validation의 정의에서 말하는「기대되는 결과」에 해당하는 것으로서 충분히 검토되고 과학적·기술적인 근거와 타당성을 가지고 정해져야 한다.
3) 설계·설치 및 가동의 확인
설비·기기나 제조공정은 본래 소기의 품질특성을 가진 제품을 제조하는데 적절하도록 설계되고, 설계대로 제작되고, 또 설계한 의도대로 가동되는 것이 당연한 일인데도 불구하고 실제는 그렇게 되지 않는 경우가 가끔 있다. 설비의 설계나 제작에는 본래 이러한 위험성이 따르며 설비나 공정이 설계대로 가동되지 않으면 규격에 맞는 품질이 제조된다고 말할 수 없다.
이와 같이 당연한 것이면서도 실제는 확인하지 않고 있는 것이 현실이며 validation을 실시함으로서 처음으로 확인되고 공정의 신뢰성이 확보된다.
4) 품질시험의 보증한계 관리
품질을 보증하기 위해서는
① 제품을 validation된 시험·검사방법에 의해서 시험하여 규격에 적합할 것과
② 신뢰성있는 공정에서 제조되고 있을 것의 두 가지가 만족해야 한다.
시험·검사방법은 정밀도에 한계가 있기 때문에 시험·검사에 적합하다는 것만으로는 품질보증이 충분하지 않다. 또 최종제품에 대한 시험만으로는 제품의 물리적·화학적·미생물학적 특성에 영향을 미치는 변동사항을 모두 검출하기에는 불충분하다.
이 부족한 점을 보완하기 위해서 제조공정의 각 단계에서 규격에 맞는 제품이 제조되고 있다는 것을 보증할 수 있는 공정관리가 이루어지지 않으면 아니 되는데 이것이 공정 validation이다.
5) 국제기준의 요건
GMP는 1963년 FDA가 CGMP를 제정·공포한 이후 1969년 WHO가 총회에서 GMP를 발표하고 가맹국에 대해서 이를 채택하는 동시에「국제 상거래에 있어서 의약품의 품질에 관한 증명제도」(WHO Certification Scheme on the Quality of Pharmaceutical Products Moving in International Commerce)를 권고함으로써 GMP활동이 활발해졌다.
그 이후 WHO, FDA, EU, ASEAN이 GMP를 개정하여 validation을 규정하고 있으며 국제적으로 통용되는 의약품의 품질보증을 위해서 validation은 필수적인 요건으로 되고 있다.
6) 경제적인 이익
Validation을 실시함으로서 다음과 같이 직·간접적인 경제적 이익을 얻을 수 있다.
【직접적인 원가절감】
(1) 제조용수 시스템에서는 사용 전에 제조단위마다 물의 검체를 취해서 시험하는 번거로움을 생략할 수 있다.
(2) 제조공정에서 균질성을 실증하기 위하여 광범위하게 검체를 취해서 시험할 필요가 없다.
(3) 멸균공정에서는 멸균시 마다 온도센서 및 생물학적지표를 사용하여 집중적인 모니터를 할 필요가 없어진다.
【간접적인 원가절감】
(1) 부적합으로 인한 제품의 폐기, 재작업, 재시험 등의 회수를 줄일 수 있다.
(2) 제조공정과 분석결과의 차이에 대한 조사시간의 낭비를 없애고 신속하게 출하할 수 있다.
(3) 제품의 클레임이나 회수(recall)의 가능성을 최소한으로 줄일 수 있다.
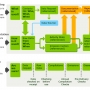 Deviation Control in a GMP process
Deviation Control in a GMP process