EC GMP 가이드 파트 I (제품) :
정의 된 절차 및 지침과의 중요한 차이는 완전히 기록되고 조사됩니다.
모든 편차는 ... 가능한 한 피해야합니다. 편차가 발생하면 적절한 경우 QC 부서의 관여와 함께 유능한 사람이 서면으로 승인해야합니다.
EC GMP 가이드 제 2 부 (API) :
확립 된 절차로부터의 이탈은 문서화되고 설명되어야한다. 중요한 편차를 조사하고 조사 및 결론을 문서화해야합니다.
미국 FDA CFR 품질 시스템 규정, Subpart G-Production 및 Process Controls, Sec. 820.70 생산 및 공정 관리.
제조 프로세스의 결과로 장치 사양의 편차가 발생할 수있는 경우 제조업체는 사양 적합성을 보장하는 데 필요한 프로세스 제어를 설명하는 프로세스 제어 절차를 수립하고 유지해야합니다.
파트 211. 완제품 의약품에 대한 현재의 훌륭한 제조 관행. Subpart F - 생산 및 공정 제어
서면 작성 및 공정 관리 절차는 다양한 생산 및 공정 관리 기능 수행시 준수되어야하며, 이행 시점에 문서화되어야한다. 서면 절차의 편차는 기록되고 정당화되어야한다.
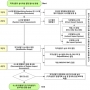 Validation Strategy Execution Service
Validation Strategy Execution Service